Незважаючи на тисячі досліджень мікробіому, перетворення цих знань на реальні методи лікування залишається складним завданням. Тепер вчені представляють покрокову дорожню карту для перенесення відкриттів мікробіома з лабораторії в клініку.
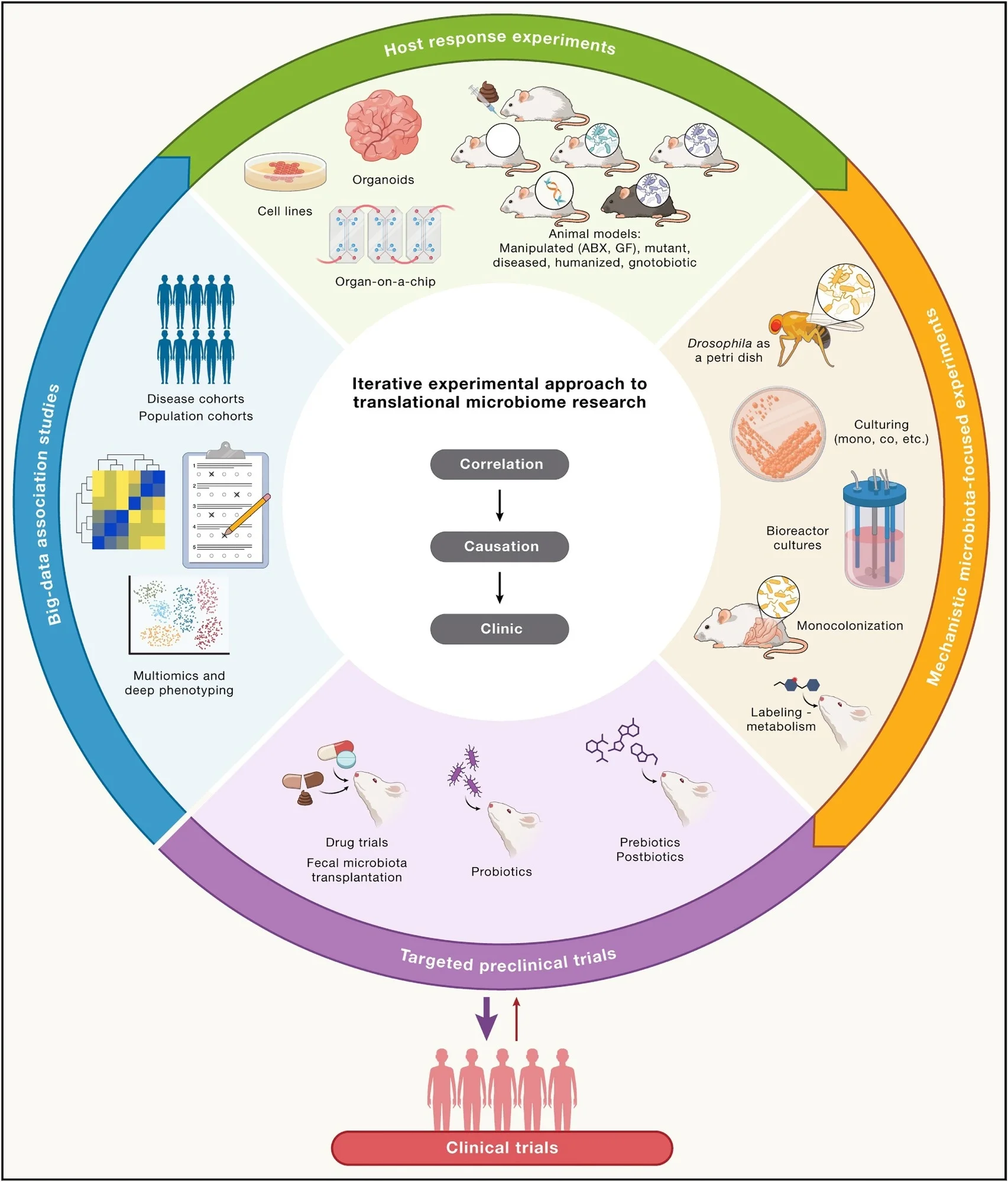
Систематичний підхід до трансляційних досліджень мікробіому
У нещодавній перспективній статті, опублікованій в журналі Cell, дослідники з’ясовують виклики, пов’язані з втіленням результатів досліджень мікробіому в практичні клінічні випробування та застосування. Вони висвітлюють останні досягнення в цій галузі, включаючи інтеграцію мультимікробів, великомасштабний мультикогортний і “метакогортний” аналіз як засоби для аналізу великих наборів даних в рамках одного дослідження.
Згодом вони пропонують систематичний та ітеративний підхід до подолання існуючих обмежень, використовуючи набори даних in silico, ex vivo, in vitro та in vivo в поєднанні з традиційними мікробіологічними методами як перший крок до переходу від теорії мікробіому до корисних клінічних результатів.
Зокрема, вони підкреслюють, що цей процес повинен включати багаторазове тестування і уточнення гіпотез, переміщення вперед і назад між різними експериментальними моделями, коли це необхідно для забезпечення надійних результатів, які можуть бути застосовані в галузі охорони здоров’я людини.
Мікробіом і здоров’я людини: кореляція versus причинність
Багато досліджень вивчали взаємозв’язок між мікробіотою людини та її хазяїном, виявляючи, що перша відповідає за кілька незамінних функцій, від очевидних (наприклад, травлення) до несподіваних (наприклад, секреція нейромедіаторів). Мікробіом людини майже унікальний, сформований поєднанням батьківських, екологічних, генетичних та поведінкових факторів, причому здоров’я мікробіому безпосередньо корелює зі здоров’ям його носіїв.
Зокрема, порушення типового складу та чисельності мікробіому (так званий “дисбактеріоз”) часто корелює з підвищеним ризиком ожиріння, серцево-судинних захворювань (ССЗ), гестаційного діабету, раку та хвороби Паркінсона. На жаль, у всіх галузях науки, від базової статистики до передових досліджень, існує твердження, що “кореляція не є причинно-наслідковим зв’язком” – ми досі не знаємо, чи є дисбактеріоз причиною, чи наслідком цих хвороб.
Подібна нестача причинно-наслідкових зв’язків існує в усіх дослідженнях мікробіому, що іноді серйозно ускладнює клінічні втручання. Ідеальним прикладом таких пасток є терапія синдрому подразненого кишківника (СПК) – хоча вважається, що трансплантація фекальної мікробіоти (ТФМ) і пробіотики покращують результати лікування СПК, їхні механізми і роль модуляції мікробіому в цих втручаннях залишаються недостатньо вивченими.
Еволюція та обмеження асоціативних досліджень мікробіому
Дослідження мікробіому все ще досить молоді, вони розпочалися у своєму нинішньому стані лише близько десяти років тому. Тоді технології секвенування все ще розвивалися, і навіть найсучасніші дослідження використовували лише невеликі набори даних і одноцентрові когорти, що дозволяло обмежити таксономічне профілювання і майже не давало можливості для узагальнення. Як наслідок, більшість наших сучасних знань про мікробіом ґрунтується на кореляційних дослідженнях.
Однак з того часу технології секвенування розвиваються безпрецедентними темпами. Сучасне повногеномне секвенування (WGS) дозволяє отримати в тисячі разів більшу роздільну здатність (роздільну здатність на рівні штаму) і значно більші набори даних, ніж це було можливо раніше, за меншу ціну. Це, в свою чергу, сприяло співпраці між дослідниками, тим самим суттєво покращуючи узагальнюваність результатів.
Аналогічні досягнення в галузі мультиоміки (метатранскриптоміки, метапротеоміки) дозволяють здійснювати профілювання на індивідуальному рівні, що, будучи поширеним на глобальному рівні, дає змогу глибше зрозуміти біологічну роль мікробних спільнот у формуванні здоров’я людини. Паралельне зростання обчислювальних потужностей та поява і розвиток алгоритмів машинного навчання (ML) ще більше допомогли розкрити раніше невидимі закономірності між ознаками хазяїна та мікробіома.
На жаль, ці досягнення, хоча і є незаперечними, не вирішують проблему відсутності прямих доказів причинно-наслідкового зв’язку між гіпотетичними аспектами мікробіому та відтворюваними клінічними результатами. Крім того, більшість асоціативних досліджень мають високий ризик неправильної інтерпретації або переоцінки спостережень, що не дозволяє точно визначити роль різних мікробних штамів у досліджуваній популяції.

Доклінічні випробування як міст до клінічного застосування
Доклінічні випробування з використанням модельних систем, орієнтованих на хазяїна або мікроби, є надійною платформою для доведення причинно-наслідкового зв’язку. Раніше вони використовувалися в медицині та науці для з’ясування механізмів, що лежать в основі ряду захворювань, включаючи рак та імуноопосередковані розлади, що призвело до розробки та перевірки клінічно корисних лікарських засобів і терапевтичних методів.
Методи, орієнтовані на хазяїна, такі як моделі in vitro (клітинні лінії, органоїди), моделі ex vivo (“орган-на-чіпі”) та моделі на тваринах in vivo, можуть допомогти встановити причинно-наслідковий зв’язок на різних рівнях складності системи. Згодом мікробіоцентричні експерименти з культивування, моноколонізація, експерименти з маркування та моделі дрозофіли (“мухи в чашці Петрі”) можуть допомогти розгадати механістичні основи взаємодії хазяїна і мікробіома.
Важливо, що ці доклінічні випробування спиратимуться на теоретичну базу кореляційних/асоціативних досліджень, що дозволить безпечно перейти до клінічного застосування (втручання, розробка ліків та лікування).
Однак автори застерігають, що перенесення результатів досліджень на тваринних моделях на людей залишається складним завданням. Анатомічні, фізіологічні та імунологічні відмінності між видами, включаючи структуру кишечника, склад мікробіому та метаболізм, можуть перешкоджати застосуванню доклінічних результатів.






